【研究資訊】Now新聞:港大噴鼻式新冠疫苗展開第一期臨床試驗 (2021年5月15日)
10/06/2021
Now新聞日前到香港大學一期臨床試驗中心進行採訪,為公眾介紹「衞活苗一號」一期臨床試驗的工作與進展。以下是Now新聞的報道:
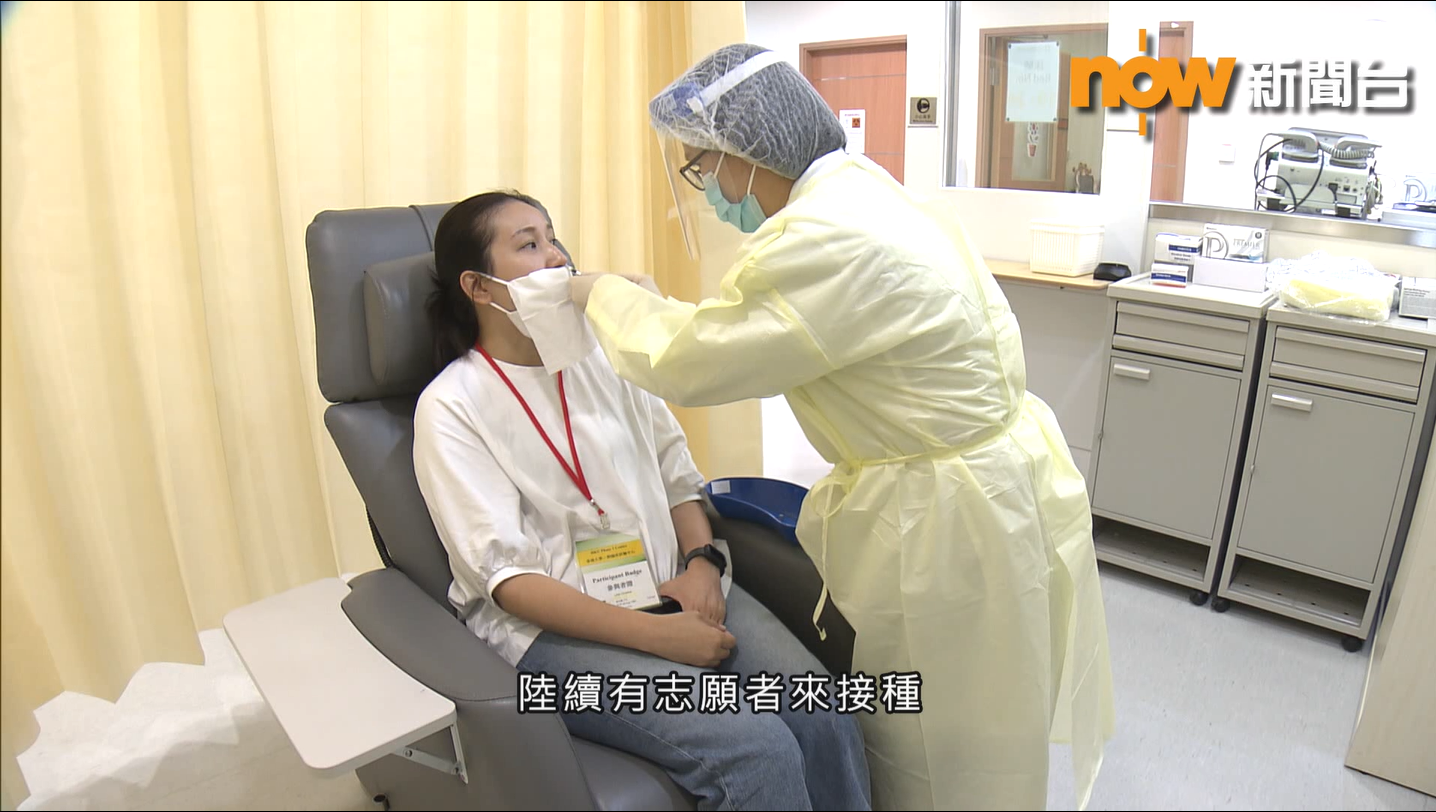
【研究資訊】2019冠狀病毒病噴鼻式疫苗「衞活苗一號」進入一期臨床試驗!
14/05/2021
由香港大學微生物學系研發的全球首款2019冠狀病毒病噴鼻式疫苗「衞活苗TM一號」獲批進入一期臨床試驗,於2021年三月在港大一期臨床試驗中心開展,目標是招募約115名健康志願者,以評估疫苗的安全性及免疫反應。
衞活苗TM一號是首款香港自主研發的疫苗順利進入臨床試驗。一期臨床試驗為期約一年半。第一部分的試驗已於2021年三月展開,約30名志願者已接種一或兩劑疫苗。第二部分將於七月開始,需要招募共85名志願者,我們仍需更多熱心的志願者支持。

【研究完成】治療高甘油三酯血症的非專利藥臨床試驗 - 已順利完成!
30/12/2020
此項目在2020年7月份開始進行招募,並成功篩選了52位合乎條件的健康志願者進行臨床試驗。這項目包分為兩部份(空腹和餐後),而每位志願者只會獲邀請參與其中一個部份。每部份所需時間約四至六星期,包括篩選期、留宿期及跟進期。過程雖受2019冠狀病毒病(COVID-19)疫情影響而稍為延遲,但全靠各位志願者的支持,以及在港大研究團隊的專業管理下,項目終於安全及高效地於2020年11月完成。

【研究完成】自身免疫病新藥一期臨床研究已順利完成!
01/12/2020
香港大學臨床試驗中心獲委託就一種治療自身免疫病的新藥進行研究,雖然新藥早前已在加拿大完成一期臨床試驗,但是次研究目的則針對該藥物於華人體內的代謝及劑量遞增時的安全性。
中心在2019年5月開始招募參加者,並成功篩選出24位合乎條件的健康志願者參加。為期十八周的研究共分為三階段,每位志願者只會參加其中一個階段,在六日五夜留宿期間接受新藥注射。由於留宿時間長,中心為志願者舉辦了兩場工作坊,包括製作花火瓶和迷你霓虹燈工作坊。研究最後於2020年11月完成。

【研究資訊】2019冠狀病毒病(COVID-19)藥物臨床研究
05/03/2020
為尋找治療2019冠狀病毒病(COVID-19)的可行方法,香港大學臨床試驗中心正聯同瑪麗醫院、威爾斯親王醫院、瑪嘉烈醫院及研發試驗性抗病毒藥物瑞德西韋 (Remdesivir) 之藥廠,籌備兩項臨床試驗,針對治療受中度至嚴重程度新型冠狀病毒感染之病人。相關團隊一致希望能加快臨床試驗的開展,過去數星期大家眾志成城,終成功於短時間內協助瑪麗醫院取得首個研究倫理委員會的批准,並預料可在本月內﹙2020年3月﹚開展相關臨床試驗。

【研究完成】創新局部麻醉劑一期臨床研究已順利完成!
31/01/2020
此項目的研究藥物EXPAREL®是一種局部麻醉劑,在2011年獲美國食品藥品監督管理局(US FDA)批准上市,用於舒緩手術後疼痛。香港大學臨床試驗中心獲委託進行研究,以了解該藥物於華裔人士體內的代謝數據及安全性。
本中心在2019年10月開始進行招募,並成功篩選了20位合乎條件的健康志願者參與臨床試驗。項目需時約54天,包括篩選、七日六夜留宿、門診及電話跟進。研究期間,每位志願者需透過多點皮下注射接受單一劑量的研究藥物。由於研究留宿時間頗長,中心為志願者舉辦了三場工作坊:土耳其馬賽克燭台工作坊、迷你紙雕小夜燈工作坊和撕藝工作坊。 最後,這項目於2020年1月完成。

【研究完成】治療哮喘新藥一期臨床研究已順利完成!
01/09/2019
是次的研究藥物Benralizumab是一種用於治療哮喘的新藥,藥物已於美國、歐盟、日本和加拿大獲批註冊上市。香港大學臨床試驗中心獲委託進行研究,以了解新藥在華人體內的代謝,以及使用不同劑量時的安全性。
招募在2019年3月開始,並成功篩選出36位健康志願者參加。研究程序包括篩選、三日兩夜留宿及跟進,需時十七星期。志願者分成兩組接受皮下注射。項目最後順利於2019年8月完成。

【研究完成】乙型肝炎創新藥一期臨床試驗已順利完成!
21/08/2019
【研究完成】非專利藥臨床試驗已順利完成!
10/07/2019
這次研究分為2個部分進行,每個部分需要健康志願者參與共2個週期,每週期需要留宿3天2夜。整個研究在2個月內已經完成。我們感謝各位志願者投入寶貴的時間,支持藥物研發。
【研究資訊】2015年在港大一期中心完成的丙型肝炎新藥一期臨床試驗,終於獲得中國藥監局批准註冊!
14/05/2018
康醫生和詩詩今天非常開心,因為志願者的付出是值得的!
2015年在香港大學一期臨床試驗中心完成的丙型肝炎新藥一期試驗,提供了重要的中國人藥物代謝數據,加速了臨床試驗計劃在中國內地的完成時間,令藥物能夠在2018年4月獲得中國國家食品藥品監督管理總局批准註冊。這種新藥於2016年1月獲得美國食品藥品監督管理局的全球首個批准,隨後香港衛生署亦於2018年1月批准在香港註冊。這種新藥能夠在美國藥監局批准後兩年便獲得中國藥監局批准,令更多病人受惠,實在值得鼓舞。
在此要感謝每位曾經參與這次臨床試驗的健康志願者,你們付出的寶貴時間以及無私奉獻,支持藥物研發工作,你們的付出絕對是意義的!
美國食品藥品監督管理局:https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm483828.htm
香港衛生署:http://www.drugoffice.gov.hk/eps/drug/productDetail/en/consumer/98948